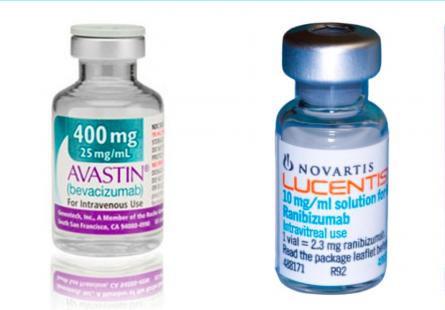
Deux médicaments ont été ajoutés à la liste de référence des groupes biologiques : Ranivisio 10 mg/ml solution injectable, biosimilaire de Lucentis (ranibizumab) et Vegzelma 25 mg/ml solution à diluer pour perfusion, biosimilaire d'Avastin (bevacizumab). Ces biosmilaires ne sont pas substituables par le pharmacien.
Deux médicaments sont ajoutés à la liste de référence des groupes biologiques similaires, selon une décision publiée par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Dans le groupe bevacizumab (ayant pour princeps Avastin 25 mg/ml, solution à diluer pour perfusion) est ajouté le biosimilaire Vegzelma, 25 mg/ml solution à diluer pour perfusion. Par ailleurs le groupe ranibizumab a été créé, avec Lucentis 10 mg/ml, solution injectable en seringue préremplie comme médicament de référence, et comme biosimilaire Ranivisio 10 mg/ml solution injectable. Rappelons que Ranivisio a obtenu sa prise en charge à 100 % à la fin de l'année dernière.
Toutefois, les pharmaciens ne sont pas autorisés à substituer ces deux biosimilaires. En effet, à l'heure actuelle, seulement deux médicaments biologiques, le filgrastim et le pegfilgrastim, sont substituables par le pharmacien.
Le bevacizumab (Avastin/Vegzelma) est un anticancéreux indiqué dans le traitement du cancer colorectal, du cancer du sein et du cancer bronchique. Il est également indiqué, via une recommandation temporaire d'utilisation (RTU), dans le cadre de traitement des formes néovasculaires de la dégénérescence liée à l’âge (DMLA).
Le ranibizumab (Lucentis/Ranivisio) est indiqué dans le traitement de la forme néovasculaire (humide) de la dégénérescence maculaire liée à l’âge (DMLA), de la baisse visuelle due à l’œdème maculaire diabétique (OMD), de la rétinopathie diabétique proliférante (RDP), de la baisse visuelle due à l’œdème maculaire secondaire à une occlusion de la branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR) et de la baisse visuelle due à une néovascularisation choroïdienne (NVC).
Les médicaments Lucentis et Avastin s'étaient retrouvés au cœur d'une affaire judiciaire au cours de laquelle les laboratoires Novartis, Roche et Genentech avaient écopé d'une amende de 444 millions d'euros (385 millions d'euros pour le premier, et 60 millions pour les deux autres) en septembre 2020. L'Autorité de la concurrence avait estimé à l'époque que les trois sociétés s’étaient rendues coupables « d’abus de position dominante, dénigrement, présentation trompeuse d’études de comparaison et pratique d’influence sur les médecins » afin de favoriser l’utilisation de Lucentis dans la dégénérescence maculaire liée à l’âge (DMLA) au détriment d’Avastin, beaucoup moins cher (une trentaine d'euros contre 1 161 euros).
Cette amende a été annulée fin février 2023 par la cour d'appel de Paris qui a considéré qu’Avastin n’ayant pas d’autorisation de mise sur le marché (AMM) dans la DMLA, mais seulement une RTU, les deux médicaments ne se faisaient pas concurrence, et que la communication des sociétés n'était ni dénigrante, ni trompeuse.

Dispensation du médicament
Tramadol et codéine sur ordonnance sécurisée : mesure reportée !
Formation continue
Transmission automatique des actions de DPC : les démarches à faire avant le 30 novembre
Relocalisation industrielle
Gel des prix sur le paracétamol pendant 2 ans : pourquoi, pour qui ?
Salon des maires
Trois axes d’action pour lutter contre les violences à l’officine