Ce papier intitulé « Transforming medicine with the microbiome » inaugure une série d’articles « Focus » publiés à l’occasion du 10e anniversaire de la revue « Science Translational Medicine » de l’Association américaine pour l’avancement des sciences (AAAS) (1).
Tandis que les premières recherches sur le microbiote (bactéries, virus, levures, Archae) étaient principalement descriptives, de nombreuses études menées ces dix dernières années ont établi des relations de causalité entre des consortia microbiens distincts, leurs fonctions, leurs effets sur la santé et les maladies. Une multitude de processus biologiques semble être contrôlé par le microbiote intestinal puisque sa composition et sa fonction sont extrêmement plastiques et facilement modifiables. Ainsi, il apparaît comme une cible prometteuse et incontournable pour développer des interventions thérapeutiques.
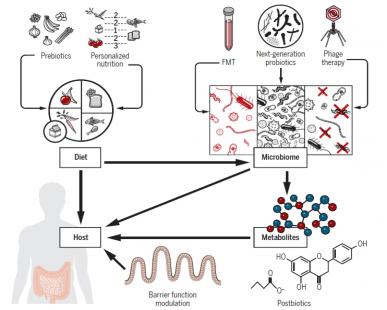
Les Dr Niv Zmora, Eliran Soffer et Eran Elinav du Weizmann Institute of Science, en Israël, esquissent à grands traits les progrès et les défis de plusieurs approches pour moduler le microbiote ou l’interface hôte-microbiote : alimentation, probiotiques, métabolites bactériens (postbiotiques), transplantation de microbiote fécal, élimination ciblée et régulation de la barrière intestinale.
Régime alimentaire personnalisé selon le microbiote
En 2006, l’équipe de Jeffrey Gordon, de l’université de Washington, a montré, dans « Nature », pour la première fois, que l’adiposité de l’hôte peut être modulée par le microbiote intestinal et sa capacité à extraire l’énergie des aliments. Ainsi le transfert du microbiote de souris obèses à des souris sans germes (axéniques) provoque une augmentation significative de poids chez ces souris.
Trois ans plus tard, la même équipe a montré que l’alimentation peut modifier de manière rapide et reproductible la composition et la fonction du microbiote. Ces découvertes ont inspiré des approches potentielles pour traiter la maladie cardiométabolique et des recherches afin d’identifier des composants alimentaires « prébiotiques » capables d’exercer des bienfaits sur la santé.
Zhao et al (Science, 2018) ont montré qu’un apport de fibres améliore le contrôle glycémique chez les diabétiques de type 2. Par ailleurs, puisque le microbiome diffère entre les individus, les recommandations et interventions nutritionnelles pourraient être personnalisées. Ainsi, Zeevi et al (Cell, 2015) ont montré que les réponses glycémiques aux aliments sont d’ordre individuelle, basées en partie sur le microbiote, et elles peuvent devenir prévisibles grâce à un algorithme d’apprentissage automatique, ce qui ouvre la voie à des régimes personnalisés pour maintenir une normoglycémie.
Les auteurs estiment que « dans la décennie à venir, des interventions alimentaires et prébiotiques basées sur le microbiote pourraient émerger comme des outils essentiels ». Ils citent notamment le contexte des maladies inflammatoires chroniques de l’intestin (MICI).
Efficacité inconstante des probiotiques
Bien que les suppléments bactériens, ou probiotiques, soient utilisés depuis plus d’un siècle pour améliorer la santé, leur efficacité reste inconsistante ; Zmora et al. ont récemment suggéré que l’efficacité pourrait aussi dépendre de la colonisation du probiotique, bonne ou mauvaise selon l’hôte et son microbiote (Cell, 2018). Des défis demeurent pour introduire cette « thérapie microbienne vivante en pratique clinique », selon les auteurs.
Rôle des métabolites bactériens (postbiotiques)
Des molécules issues du microbiote, ou thérapies postbiotiques, se sont montrées prometteuses dans des modèles animaux. Par exemple, les acides gras à chaine courte (AGCC), produits par la fermentation microbienne dans le colon des fibres alimentaires ou pouvant être administrés en suppléments, diminuent l’inflammation intestinale chez la souris atteinte de colite. Autre exemple, la reconstitution en flavonoïdes peut atténuer le regain de poids après succès d’un régime amaigrissant. De plus larges études seront nécessaires.
Transplantation de microbiote fécal
En 2013, van Nood et al (NEJM) ont montré qu’un transfert de microbiote fécal est plus efficace que la vancomycine pour guérir les patients souffrant d’infection récidivante à Clostridium difficile. Depuis, le transfert fécal est étudié dans d’autres contextes, dont la maladie cardiométabolique et les MICI. La prudence reste de mise étant donné le risque de transmission de maladies ou d’autres traits liés au microbiote du donneur. Les futures études devront élucider pourquoi certains dons de selles ou « super donneurs » sont supérieurs. Les auteurs entrevoient à l’avenir des thérapies sur mesure reposant sur des signatures microbiennes personnalisées liées à des fonctions précises.
Élimination ciblée et régulation de la barrière intestinale
Une intervention éliminant spécifiquement les pathobiontes (micro-organismes délétères) dans l’écosystème du microbiote serait fort utile. À ce titre, les bactériophages (ou phages), des virus infectant les bactéries, suscitent un regain d’intérêt car ils peuvent cibler des bactéries spécifiques et ont moins d’effets secondaires que les antibiotiques. Cependant l’approche fait face à des défis majeurs.
Une autre approche peu explorée consisterait à cibler directement la barrière intestinale de l’hôte, et des facteurs modulant la barrière commencent à émerger.
Enfin, outre les défis techniques et translationnels, les auteurs soulignent le peu d’études portant sur les composantes non bactériennes du microbiote (virome, mycome et parasitome) alors que l’on reconnait de plus en plus l’importance de leurs fonctions régulatrices.
(1) N. Zmora et al, Science Translational Medicine, 10.1126/scitranslmed.aaw1815, 2019.

Pharmaco pratique
Accompagner la patiente souffrant d’endométriose
3 questions à…
Françoise Amouroux
Cas de comptoir
Les allergies aux pollens
Pharmaco pratique
Les traitements de la sclérose en plaques