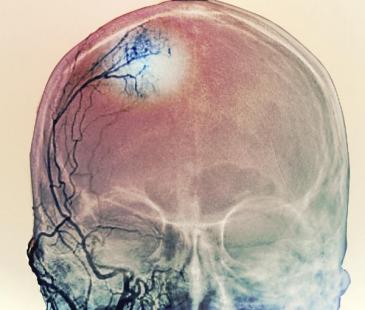
Trois femmes traitées par Androcur (acétate de cyprotérone) portent plainte contre le Laboratoire Bayer. Elles ont été opérées d’un méningiome avec séquelles, dont l’apparition pourrait être due au médicament.
Trois femmes traitées par Androcur et accusant ce médicament d'être à l'origine d’un méningiome opéré avec séquelles (tumeur du cerveau le plus souvent bénigne), viennent de lancer une procédure judiciaire contre Bayer. Cette volonté de poursuivre en justice le laboratoire et l’Agence nationale de sécurité sanitaire (ANSM) avait été annoncée en septembre dernier, pour 5 femmes. La plainte au civil de 3 de ces femmes est aujourd’hui effective. La procédure vise également l'Office national d'indemnisation des accidents médicaux (ONIAM) attaqué, comme l’ANSM, pour « défaut d’information » sur les risques encourus avec ce traitement et « défectuosité » du médicament, évoque Me Charles Joseph-Oudin, l’avocat des plaignantes. Le tribunal de grande instance de Bobigny a fixé la première audience au 29 mai, selon Me Oudin. L'objectif est d'obtenir la désignation d'experts judiciaires qui doivent évaluer le rôle du médicament dans l'apparition des méningiomes en vue d'éventuelles indemnisations.
Le groupe Bayer a précisé ce matin n'avoir « pas encore reçu officiellement les assignations en justice » et « réserve ses commentaires aux magistrats qui auront à examiner ces dossiers ».
Rappelons que le risque de méningiome est bien réel. Depuis 2011, il est mentionné dans le résumé des caractéristiques du produit (RCP). De plus, fin août 2018, une nouvelle étude de l'ANSM et de l'assurance-maladie a précisé ce risque de méningiome : il est multiplié par 7 chez des femmes traitées à fortes doses avec ce médicament pendant plus de 6 mois.
Bayer indique « analyser actuellement, avec les autorités de santé, les résultats de cette étude », qui apporte de nouvelles données sur le risque de méningiome associé à l’utilisation d'Androcur lorsqu'il est utilisé de façon prolongée et à forte dose. « Ce risque de méningiome, mentionné dans la notice du médicament, fait l'objet d'une surveillance continue, dans le respect de la réglementation », précise le laboratoire, qui « invite les patients(e)s traité(e)s par Androcur, en cas d’inquiétude, à se rapprocher de leur médecin traitant ».

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %