L'agence européenne du médicament (EMA) recommande d'ajouter un avertissement pour les troubles rénaux et gastro-intestinaux graves associés à l'usage des spécialités contenant l'association codéine-ibuprofène.
Le Comité d'évaluation des risques en matière de pharmacovigilance (PRAC) recommande, dans un avis du 30 septembre 2022, une modification du résumé et caractéristiques du produit (RCP) des médicaments associant la codéine à l'ibuprofène. L'agence européenne souhaite inclure une mise en garde contre les effets nocifs graves, voire mortels, en particulier lorsque ces spécialités sont utilisées pendant des périodes prolongées à des doses supérieures aux doses recommandées.
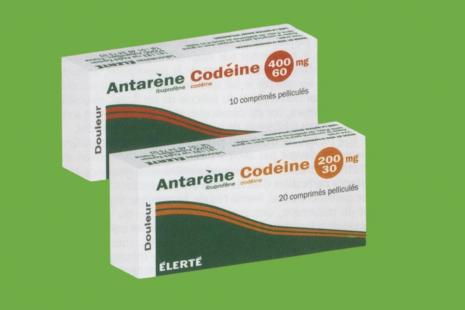
En France, les seules spécialités associant ces deux principes actifs sont Antarène Codéine 200 mg/30 mg cp pelliculés et Antarène Codéine 400 mg/60 mg cp pelliculés.
« L'utilisation répétée de codéine avec de l'ibuprofène peut entraîner une dépendance (accoutumance) et un abus en raison du composant codéine », indique le PRAC qui a examiné plusieurs signalements de toxicités rénales, gastro-intestinales et métaboliques relatifs à des cas d'abus et de dépendance à la codéine et à l'ibuprofène, dont certains ont été mortels.
Le PRAC a ainsi constaté que, lorsqu'elle est prise à des doses supérieures aux doses recommandées ou pendant une période prolongée, la codéine associée à l'ibuprofène peut endommager les reins, les empêchant d'éliminer correctement les acides du sang dans l'urine (acidose tubulaire rénale). Un dysfonctionnement rénal peut également entraîner de très faibles taux de potassium dans le sang (hypokaliémie), ce qui peut à son tour provoquer des symptômes tels qu'une faiblesse musculaire et des étourdissements. Par conséquent, l'acidose tubulaire rénale et l'hypokaliémie seront ajoutées aux informations sur le produit en tant que nouveaux effets indésirables.
Étant donné que les médicaments contenant une combinaison de codéine et d'ibuprofène sont autorisés au niveau national, le comité d'évaluation a convenu de messages clés que les autorités nationales compétentes peuvent utiliser lors de la rédaction de leur communication aux professionnels de santé concernés et pour informer les patients des signes d'abus et de dépendance, ainsi que des risques de préjudice. Il doit être conseillé aux patients de consulter leur médecin s'ils souhaitent utiliser la codéine avec de l'ibuprofène plus longtemps que recommandé et/ou à des doses supérieures à celles recommandées.
Le PRAC a également noté qu'il existe des médicaments contenant de la codéine avec de l'ibuprofène qui sont disponibles sans prescription médicale dans l'UE (ce n'est pas le cas en France). Comme la plupart de ces cas ont été signalés dans des pays où ces médicaments sont disponibles sans ordonnance, l'agence européenne a estimé que le statut de médicament délivré uniquement sur ordonnance serait la mesure de minimisation des risques la plus efficace pour atténuer les dommages associés à l'abus et à la dépendance à ces produits.
Ces recommandations, ainsi que les messages clés pour la communication, seront envoyés aux autorités nationales compétentes qui peuvent décider de la nécessité d'une communication supplémentaire au niveau national.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %