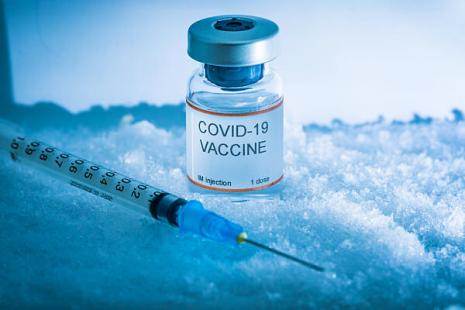
Pfizer et BioNTech affirment que leur vaccin contre le Covid-19, Comirnaty, peut être stocké à la température d’un congélateur médical standard pendant deux semaines. Des données soumises vendredi dernier à l’agence du médicament américaine (FDA) et qui, si elles sont validées par les autorités, faciliteraient la logistique des campagnes de vaccination.
Tout comme le vaccin à ARNm de Moderna, le vaccin de Pfizer-BioNTech pourrait être stocké entre -15 °C et -20 °C, sur une durée néanmoins limitée à deux semaines mais suffisante pour faciliter les campagnes de vaccination dans les pays qui utilisent ce vaccin, notamment en termes de transport. Une possibilité que les concepteurs du vaccin avaient envisagé dès le mois de novembre, lors de leurs toutes premières communications sur l’efficacité de ce vaccin qui n’était alors pas encore autorisé, mais qui nécessitait de nouvelles études. C’est chose faite. En revanche, la conservation à long terme ne change pas et requiert toujours l’utilisation de supercongélateurs pour atteindre des températures de -70 °C à -80 °C.
Pfizer et BioNTech ont transmis vendredi dernier leurs données sur la conservation de Comirnaty à la FDA. Si l’agence valide ces nouvelles règles de stockage, cela pourrait, estime Ugur Sahin, patron et cofondateur de BioNTech, « faciliter la gestion de notre vaccin dans les pharmacies et permettre une plus grande flexibilité dans les centres de vaccination ». Comirnaty peut déjà être conservé dans un réfrigérateur standard, entre +2 °C et +8 °C, pendant 5 jours. Les contraintes de conservation du vaccin de Moderna restent plus souples : à -20 °C pendant six mois, puis entre +2 °C et +8 °C pendant 30 jours. BioNTech et Pfizer continuent à travailler sur « de nouvelles formules qui pourraient rendre notre vaccin encore plus facile à transporter et utiliser », indique Ugur Sahin.
Par ailleurs, les deux laboratoires ont annoncé jeudi dernier le lancement d'une étude pour déterminer l'efficacité et la sécurité de Comirnaty chez les femmes enceintes en bonne santé. Cet essai sur 4 000 personnes se déroulera à la fois aux États-Unis, au Canada, en Argentine, au Brésil, au Chili, au Mozambique, en Afrique du Sud, au Royaume-Uni et en Espagne. Ils prévoient également de lancer « dans les prochains mois » une étude sur des enfants de 5 à 11 ans. Des données concernant des enfants entre 12 et 15 ans, issues de l'étude clinique précédente, seront soumises aux autorités au deuxième trimestre cette année.
Avec l'AFP.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %