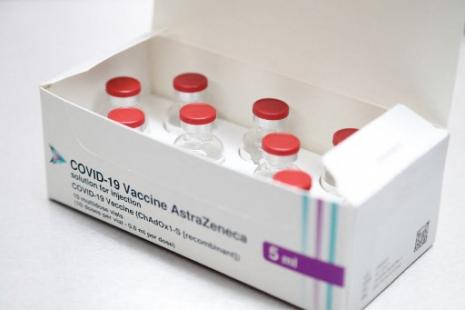
L’Agence européenne du médicament (EMA) a annoncé ce matin avoir reçu le dossier de demande d’autorisation de mise sur le marché (AMM) du vaccin contre le Covid-19 développé par l’université d’Oxford et le Laboratoire AstraZeneca. Ce vaccin, facile à conserver, est particulièrement attendu pour faciliter le déploiement de la campagne de vaccination.
Comme pour les vaccins déjà autorisés de Pfizer-BioNTech et de Moderna, l’EMA a mis en place une évaluation en continu (rolling review) pour le vaccin d’AstraZeneca-Oxford. La semaine dernière, l'agence avait demandé des données supplémentaires sur l’efficacité et la sécurité du vaccin au laboratoire et attendait qu’il dépose un dossier de demande d’AMM. C’est aujourd’hui chose faite, ce qui permet à l’EMA d’annoncer une potentielle prise de décision le 29 janvier, après un examen accéléré. Une date qui correspond aux annonces de la présidente de la Haute Autorité de santé (HAS), Dominique Le Guludec, vendredi dernier, qui se réjouissait que, tout comme les deux vaccins déjà autorisés, trois autres avaient toutes les chances d’être homologués plus tôt que prévu, dont celui d’AstraZeneca initialement espéré pour février-mars.
Moins cher que les deux vaccins déjà autorisés (environ 2,50 euros la dose), et sans contrainte particulière quant à sa conservation et son transport, ce vaccin à vecteur viral recombiné (adénovirus de chimpanzé) pourrait largement modifier et faciliter la campagne de vaccination qui a débuté le 27 décembre dernier en Europe. Connu jusqu’alors sous la dénomination de ChAdOx1 ou AZD1222, il est notamment déjà utilisé au Royaume-Uni où il bénéficie d’une autorisation temporaire d’utilisation en urgence depuis le 4 janvier. Il se présente en flacon multidose et s’administre par voie intramusculaire en deux doses. Les résultats de phase 3, annoncés par le laboratoire le 23 novembre dernier et publiés dans « The Lancet » le 8 décembre, tablent sur une efficacité globale de 70,4 %, efficacité qui grimpe à 90 % lorsque le schéma de vaccination est d’une demi-dose en première injection et d’une dose standard quelques semaines plus tard. Ce schéma ayant été administré par erreur et sur un groupe limité, une étude supplémentaire doit compléter les données actuellement connues.
AstraZeneca affirme avoir la capacité de fabriquer 3 milliards de doses en 2021. L’Europe lui en a précommandé 400 millions.

Industrie pharmaceutique
Gilead autorise des génériqueurs à fabriquer du lénacapavir
Dans le Rhône
Des pharmacies collectent pour les Restos du cœur
Substitution par le pharmacien
Biosimilaires : les patients sont prêts, mais…
D’après une enquête d’UFC-Que choisir
Huit médicaments périmés sur dix restent efficaces à 90 %